Menu
close
Produits
Votre solution complète
Tous les produits
Télécharger notre catalogue
Obtenir notre catalogue
Applications
Pionnière de l’observation des domaines inexplorés de la recherche biomédicale, Nüvü™ met au point des caméras novatrices qui répondent aux défis de détection les plus complexes dans des conditions de flux lumineux ultra-faibles.
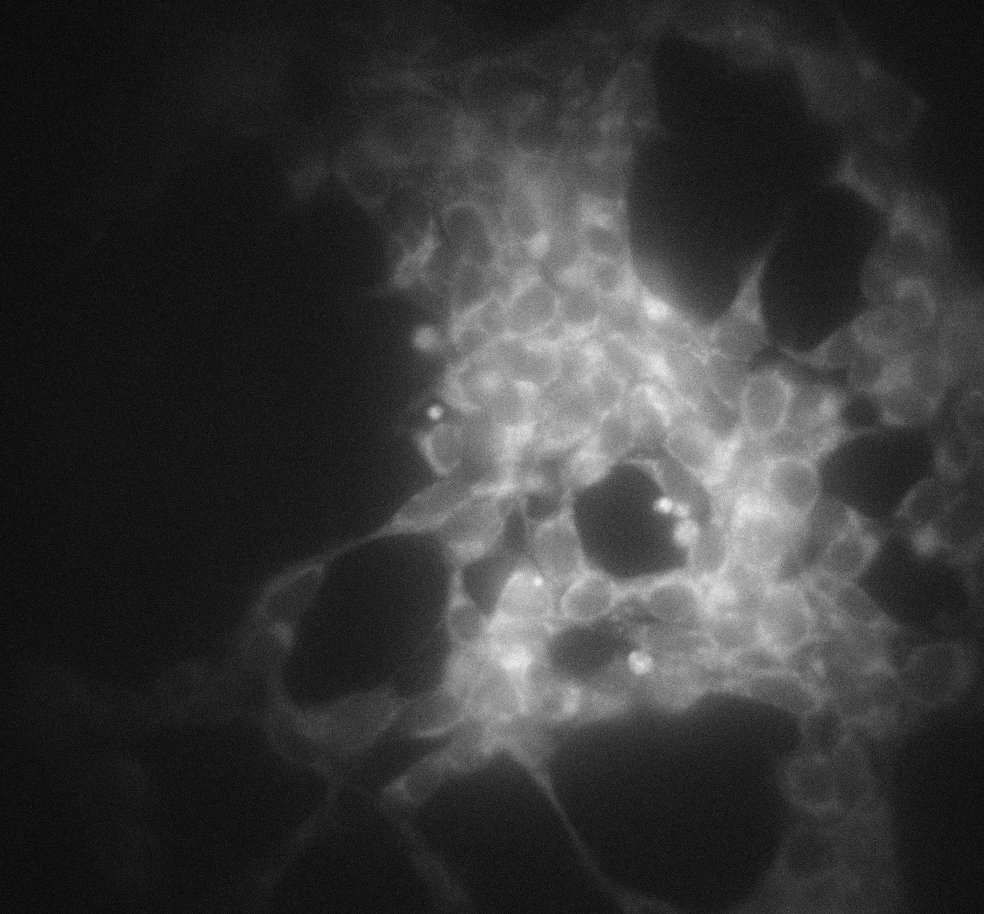
L’imagerie multimodale permet une récolte faste d’informations d’un seul coup en mettant à profit les différentes propriétés d’une sonde. Devenue une norme dans les études précliniques, cette technique fonctionne grâce à l’injection de marqueurs moléculaires qui sont détectés par de multiples méthodes comme la tomographie par émission de positons (PET) et la tomographie optique. Par exemple, on peut recourir à des sondes radioactives et légèrement fluorescentes dont les émissions sont ensuite détectées par une caméra et d’autres dispositifs.
Chaque modalité de la sonde possède divers seuils de détection, mais la molécule doit être détectable et sécuritaire. Toutefois, les plages de sensibilité des différentes modalités peuvent se recouper; certaines peuvent être néfastes à des concentrations élevées (mais qui seraient souhaitées afin de générer suffisamment de fluorescence), et d’autres entravent tout simplement la fluorescence à concentration croissante. Dans tous les cas, l’émission de la sonde est très faible et sujette à la contamination par le bruit du dispositif de détection.
Tout en employant les mêmes capteurs EMCCD que ses concurrents, Nüvü Camēras offre « des caractéristiques très attrayantes pour l’imagerie biomédicale ultrasensible avec le meilleur RSB dans les applications de faible luminosité. » (Bérubé-Lauzière, 2013) Pour l’imagerie multimodale faisant appel à la fluorescence, Nüvü™ résout ainsi le défi de la détection de l’émission d’une sonde à faible concentration. De plus, grâce à son taux de lecture atteignant 20 MHz, les caméras EMCCD de Nüvü™ ouvrent la porte à la tomographie optique en temps réel à 360°.
L’équipe de Y. Bérubé-Lauzière (Université de Sherbrooke) a présenté les résultats de la caractérisation in vitro et in vivo de molécules de phtalocyanines auxquelles étaient attachés des atomes de zinc ou de cuivre, créant ainsi des biomarqueurs multimodaux. Les résultats inclus dans l’affiche ci-dessous démontrent les limites de leur détection avec une caméra Nüvü™.
La spectroscopie Raman étudie les propriétés optiques, vibratoires et électroniques des matériaux, qu’ils s’agissent de protéines, de cellules ou même de polymères, et ce, de manière non destructive. Cette technique permet plus particulièrement d’identifier et étiqueter des molécules en déterminant leurs symétries et la nature de leurs liens chimiques. Grâce à l’imagerie Raman, il est possible d’observer un objet d’intérêt en plus d’obtenir un spectre Raman complet pour chaque pixel du capteur.
Étant donné que le signal produit par l’effet Raman est quasi imperceptible, l’acquisition de spectres ou d’images est un processus lent qui peut prendre des heures pour atteindre la résolution spectrale souhaitée. Raffiner la résolution spectrale se fait au détriment de la durée d’acquisition étant donné la diminution du signal atteignant la caméra.
La spectroscopie et l’imagerie Raman peuvent être accélérées jusqu’à un facteur 10 grâce à la sensibilité sans égal des caméras Nüvü™, et ce, sans utiliser de procédés tels que CARS (Coherent Anti-Stokes Raman Spectroscopy) ou SERS (Surface-Enhanced Raman Spectroscopy). En effet, les signaux plus faibles peuvent être détectés afin d’obtenir un spectre complet plus rapidement. Ainsi, la durée des périodes requises pour le balayage spectral et spatial n’en est que réduite.
F. Thouin de l’Université de Montréal a démontré l’efficacité de la caméra EMCCD EM N2 Nüvü™ afin d’employer l’imagerie Raman. Ses résultats sont présentés dans l’affiche disponible ci-dessous.
Par ailleurs, l’équipe du professeur Frédéric Leblond (Université de Montréal) ont fait la démonstration d’une sonde spectroscopique Raman portable à champ large pour un usage projeté en neurochirurgie.
La chirurgie guidée par fluorescence se base sur la propriété de certaines molécules à s’accumuler sélectivement dans des tissus particuliers. Avec la fluorescence, elles aident à mieux distinguer les cellules saines et des cellules malades. L’amélioration de cette technique chirurgicale mènera ultimement à une meilleure résection des tissus malades dans le traitement de multiples maladies comme les cancers ovariens ou du cerveau. L’élimination complète des cellules malignes augmentera la rémission ainsi que l’espérance de vie d’un patient.
Les marqueurs fluorescents employés en imagerie in vivo émettent un faible signal. Pour guider efficacement les chirurgiens dans la salle d’opération, un système d’imagerie doit mener de longues acquisitions pour que suffisamment de photons s’accumulent sur le détecteur. Non seulement des temps d’intégration plus longs accroissent le courant d’obscurité, mais ils augmentent également la durée des procédures en salle d’opération. Au final, c’est l’espérance de vie du patient sous le bistouri qui en souffre.
Le contrôleur EMCCD de Nüvü Camēras, à la fine pointe de la technologie d’imagerie à faible flux, diminue le bruit d’injection de charge associé à des acquisitions rapides grâce à une électronique novatrice et brevetée. Il permet également une multiplication du signal jusqu’à 5000 fois plus grande que le signal entrant, rendant par la même occasion le bruit de lecture négligeable. Tous ces éléments permettent d’atteindre des RSB supérieurs plus rapidement, rendant possible la chirurgie guidée par fluorescence possible en dépit des faibles émissions des marqueurs.
Une équipe pluridisciplinaire confirme que le système d’imagerie spectroscopique intégrant une caméra EMCCD HNü 512 de Nüvü surpasse les performances des systèmes d’imagerie actuels basés sur la technologie sCMOS pour la résection de tumeurs du cerveau guidée par la fluorescence de la protoporphyrine IX. Les détails sont présentés dans l’article ci-dessous.
Une application particulièrement prometteuse en sciences biomédicales est l’imagerie de molécules uniques au coeur de cellules marquées par des protéines fluorescentes. Toutefois, alors que les molécules bioluminescentes émettent leur propre lumière, les marqueurs fluorescents doivent être stimulés par une source de lumière plus énergétique pour émettre des photons.
De ce fait, l’imagerie des marqueurs fluorescents est limitée par leur photoblanchiment, influencé par l’intensité du laser d’excitation ainsi que la durée de l’acquisition d’une image. Optimiser le temps d’exposition et la source d’excitation permet d’appliquer efficacement l’imagerie à molécule unique.
Nüvü Camēras propose des caméras EMCCD exceptionnelles dont les performances répondent aux plus grandes exigences de l’imagerie de molécules uniques : vitesses d’acquisition élevées, fréquence d’images supérieure et haut RSB grâce au plancher de bruit le plus faible sur le marché. Ainsi, la technologie Nüvü™ solutionne élégamment le problème du photoblanchiment en permettant à l’utilisateur de diminuer l’intensité de la source d’excitation.
L’Institut de recherche en immunologie et en cancérologie (IRIC), en collaboration avec le Département de pathologie et de biologie cellulaire de l’Université de Montréal, a confirmé l’accroissement des performances d’un système d’imagerie à molécules uniques couplé à une caméra Nüvü™ EM N2 en mode de comptage de photons. Leur affiche est présentée ci-dessous.
Paul De Koninck du Centre de recherche de l’Institut en santé mentale de Québec démontre la possibilité de détecter et suivre 4 types de récepteurs synaptiques. Malgré un nombre de photons extrêmement restreint dans le puits quantique (entre 100 et 150 photons), ce qui limite généralement la capacité de localisation des systèmes optiques, le faible niveau de bruit de la caméra de Nüvü a permis d’atteindre une résolution inférieure au pixel.
Les réactifs bioluminescents sont fréquemment employés en diagnostic biologique afin d’évaluer et quantifier la concentration de certaines molécules d’intérêt. L’exemple par excellence est la détection d’adénosine triphosphate (ATP) dans le cadre de tests de biocompatibilité et de cytotoxicité; la combinaison de luciférine et de luciférase devient luminescente en présence d’ATP. Si les concentrations d’ATP en jeu sont inférieures à celles des réactifs, le signal produit par la bioluminescence est linéairement dépendant de la quantité d’ATP. Ainsi, on peut générer des courbes de calibration pour quantifier précisément les concentrations d’ATP contenues dans les prélèvements biologiques.
Les méthodes de détection courantes limitent l’évaluation quantitative des concentrations d’ATP à l’échelle de la picomole. En effet, les caméras disponibles sur le marché n’atteignent pas la sensibilité requise afin d’observer des concentrations de luciférine + luciférase encore plus faibles.
Nüvü™ propose une gamme de caméras qui ouvrent la porte à une meilleure détection de l’ATP grâce à leur contrôleur novateur ainsi qu’à une encapsulation diminuant significativement le plancher de bruit de l’appareil. Nüvü Camēras offre également l’option du comptage de photons, repoussant la limite de détection de l’ATP d’un facteur 1000, passant d’une concentration de l’ordre de la picomole à la femtomole.
Les images ci-dessous sont celles de microplaquettes contenant des solutions de diverses concentrations d’ATP, de 5 à 156 femtomoles, et étudiées en triplicata. Chaque image a été acquise à l’aide de la caméra EM N2 1024 de Nüvü™.
30 seconds total exposure time – single frame acquisition and conventional mode at 100 kHz at -85ºC
Figure 1: Acquisition unique de 30 secondes en mode conventionnel (CCD). L’image présente les performances attendues d’une caméra CCD ou sCMOS haut de gamme. Sans employer le registre de multiplication des électrons afin d’amplifier le signal de bioluminescence, les solutions d’ATP sont à peine identifiables.
5 seconds total exposure time – summation of 5 single frames, each acquired over 1 second, in EM mode at 10MHz with an EM gain of 5000 at -85ºC.
Figure 2: Superposition de cinq clichés acquis en une seconde en mode EM. En diminuant le plancher de bruit à l’aide du registre de multiplication d’électrons de la caméra, les six concentrations d’ATP sont perceptibles. Le rapport signal sur bruit (RSB) varie entre 1,9 et 14,1 (ou, de façon équivalente, de 2,8 à 11,5 dB).
5 seconds total exposure time – summation of 5 single frames, each acquired over 1 second, in Photon Counting EM mode at 10MHz with an EM gain of 5000 at -85ºC
Figure 3: Superposition de cinq clichés acquis en une seconde en mode comptage de photons. La suppression du facteur de bruit excédentaire (ENF) grâce au comptage de photons accroît le RSB qui se situe maintenant entre 6,6 et 51,3 (8,2 à 17,1 dB). Des concentrations d’ATP aussi faibles que 5 femtomoles sont observées à fort contraste. Images fournies par le Centre hospitalier universitaire de Sherbrooke.
Prof. Ewa Goldys et son équipe à University of New South Wales sont des pioniers dans la bio-imagerie sans marqueurs externes et la caractérisation de tissus. Avec la HNü 1024 de Nüvü, ils ont investigués avec succès l’impact du vieillissement sur les cellules souches grâce à une analyse multi-spectrale de la fluorescence de leurs différents composés chimiques.
Le transfert d’énergie de résonance de type Förster (FRET) et le transfert d’énergie de résonance par bioluminescence (BRET) sont deux techniques couramment utilisées afin d’étudier la cinétique des réactions intermoléculaires en biologie et en chimie. Ces phénomènes surviennent à l’échelle nanoscopique et produisent ainsi peu de lumière.
Étant donné l’échelle du transfert d’énergie, l’imagerie FRET et BRET souffrent de la faible intensité du signal arrivant à la caméra. Dans le cas de l’imagerie FRET, le photoblanchiment – l’altération photochimique d’une molécule émittrice engendrée par l’intensité de la source d’excitation – interfère également avec l’acquisition de données fiables.
Heureusement, les caméras EMCCD de Nüvü Camēras surmontent ces obstacles en proposant des durées d’exposition plus courtes, des fréquences d’image supérieures et un RSB plus élevé. De plus, un utilisateur peu diminuer l’intensité du laser d’excitation en imagerie FRET, minimisant ainsi le photoblanchiment grâce à la sensibilité accrue des caméras.
L’article suivant présente les travaux du groupe du professeur Michel Bouvier à l’Institut de Recherche en Immunologie et en Cancérologie (IRIC). Cette recherche met en valeur la puissance des caméras de Nüvü dans l’étude des interactions protéiniques à l’aide du BRET.
Bien que les biomarqueurs soient non-invasifs, ce qui leur confère un avantage en recherche ainsi qu’en diagnostic, l’imagerie de petits animaux souffre de la faible intensité de l’émission de ces molécules. Pire, une importante fraction de cette émission se perd en raison de l’absorption et de la diffusion de celle-ci dans les tissus de l’organisme. Au final, le signal lumineux atteignant la caméra est extrêmement faible.
Grâce à leur sensibilité inégalée en condition d’ultra faible flux, les caméras de Nüvü™ sont tout indiquées pour l’imagerie de petits animaux. Elles offrent le meilleur gain EM et procurent le RSB le plus élevé parmi toutes les caméras EMCCD sur le marché. Non seulement la technologie Nüvü Camēras permet-elle de détecter une quantité considérablement plus grande de photons, mais elle supporte des vitesses d’acquisition supérieures tout en préservant un niveau de bruit faible, générant ainsi des images d’une précision incomparable.
Des études novatrices menées par l’équipe de F. Lesage de l’Institut de Cardiologie de Montréal, en collaboration avec l’Institut d’ingénierie biomédicale de l’École Polytechnique de Montréal, démontrent le potentiel des caméras EMCCD de Nüvü™ pour l’imagerie par fluorescence. Le groupe a présenté Ultrasound guided fluorescence tomography à l’occasion de la conférence Photonics North 2012. Ils proposent « un modèle hybride de système d’imagerie combinant fluorescence et ultrasons (US) a été exploré pour une meilleure reconstruction de l’imagerie par fluorescence. »
Les figures ci-dessous démontrent l’efficacité du système d’imagerie hybride fluorescence/ultrasons de petits animaux sur des souris. Des fluorophores CCy5.5 ont été injectés par intraveineuse à une concentration de 0,1 mg/L. Les zones colorées présentent les secteurs imagés en superposant les mesures de fluorescence aux images de contrôle.
D’autres résultats ont été publiés dans l’édition mai 2014 de la revue Biomedical Optics Express avec cette fois-ci un modèle hybride IRM-TMF.
Lorsqu’elles voyagent plus rapidement que la lumière dans un milieu donné, des particules chargées de haute énergie, notamment les électrons et les positons, émettent du rayonnement Cerenkov. Un tel rayonnement, communément mesuré dans des expériences de physique des hautes énergies, se révèle être un outil prometteur pour l’imagerie biomédicale, notamment en imagerie multimodale.
Un colorant radioactif injecté dans des biomolécules ou des organismes produit inévitablement un rayonnement Cerenkov dans les spectres du visible et du proche infrarouge. Cependant, ce signal, déjà faible, est facilement absorbé par les tissus. Dans ces conditions, seule une caméra à haute sensibilité est en mesure de répondre aux exigences associées à sa détection.
Les caméras EMCCD de Nüvü™, comme celles de la série HNü, sont parfaitement adaptées l’imagerie de la luminescence Cerenkov. Grâce à une efficacité quantique élevée, une sensibilité exceptionnelle dans le visible et le proche infrarouge ainsi qu’un très faible bruit, et ce, même à gain EM élevé, elles peuvent détecter les photons Cerenkov. Mieux encore, le comptage de photons, qui s’emploie facilement à l’aide de la technologie Nüvü Camēras, peut fournir la précision requise pour cette technique d’imagerie de pointe.
Plusieurs domaines de recherche biomédicale peuvent désormais tirer profit de la caméra la plus sensible sur le marché. L’observation de photons isolés à des fréquences élevées d’imagerie, le tout avec un RSB incroyablement haut, est maintenant possible grâce aux caméras EMCCD de Nüvü™. Avec un bruit de fond inférieur à 0.001 ē/pix/image ainsi qu’un gain EM allant jusqu’à 5000, ces caméras peuvent servir dans plusieurs domaines de recherche biomédicale pour y étudier des phénomènes qui n’ont jusqu’alors jamais été examinés avec autant de précision, de sensibilité et de fiabilité.
Le bruit de fond d’une EMCCD résulte de la combinaison du courant sombre et de l’injection de charge. Le bruit de lecture, le facteur de bruit excessif et le transfert de charge incomplet ont aussi un effet sur le bruit de fond. La technologie brevetée de pointe de Nüvü Camēras surmonte ces obstacles avec élégance. Son faible bruit permet d’amplifier le signal jusqu’à 5000 fois grâce à la multiplication des électrons avant la numérisation, alors que les EMCCD typiques se limitent à un gain EM supérieur à 1000 par manque d’efficacité. Elle peut aussi être combinée à la multitude d’autres méthodes de réduction du bruit disponibles grâce à la technologie CCCP. De plus, la technologie avancée des caméras de Nüvü Camēras établit de nouveaux standards à l’aide d’ingénierie créative et innovante afin de réduire physiquement le bruit du système sans même un seul algorithme de filtrage par ordinateur.
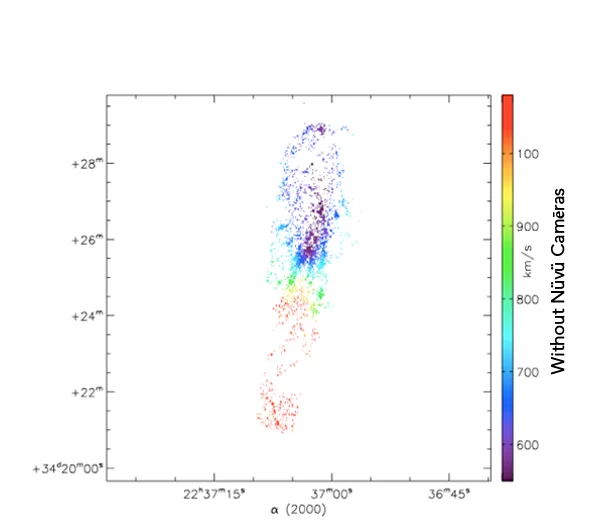
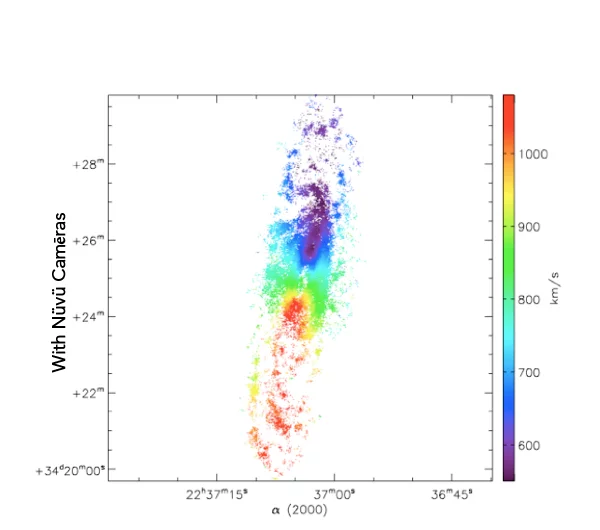
Ce que vous voyez est exactement la même galaxie imagée avec et sans la technologie d’imagerie de Nüvü Camēras. Imaginez maintenant que chaque étoile est une cellule cancéreuse, quelle technologie préférez-vous?
Les innovations spatiales ont toujours été à la fine pointe des nouvelles technologies. C’est la raison pour laquelle la technologie de Nüvü, bien qu’initialement conçue pour l’astronomie, repousse désormais les limites de l’observable en sciences de la vie.
Des questions sur l'EMCCD ou l'imagerie à faible flux lumineux ? Les experts de Nüvü Camēras peuvent vous conseiller sur les options d'imagerie en basse lumière.